文献分享
创新发展 展望未来
近年来,免疫疗法以前所未有的速度改写癌症治疗版图,成为对抗肿瘤的核心力量。人体免疫系统中,免疫检查点分子如同“安全刹车”,能精准调控免疫细胞活性,避免免疫反应失控损伤健康组织。然而,狡猾的癌细胞却深谙此道,它们通过激活免疫检查点通路,抑制T细胞的抗肿瘤活性,从而成功逃避免疫系统的“追杀”。
目前,针对 PD-1、CTLA-4等经典免疫检查点的抑制剂已在临床治疗中大放异彩,显著改善了众多癌症患者的生存质量与预后。而淋巴细胞激活基因3(LAG3)作为新兴靶点,正快速成为科研与临床关注的焦点。LAG3主要表达于活化的T细胞表面,与PD-1、CTLA-4协同作用,持续压制T细胞活性,为肿瘤的免疫逃逸 “保驾护航”。2022年,全球首款靶向LAG3的药物获批上市,这不仅是肿瘤免疫治疗领域的重大突破,更预示着以LAG3为靶点的新型抗癌策略,有望为癌症患者带来更多生存希望。
2025年3月17日,上海科技大学王皞鹏教授,中国科学院分子细胞科学卓越创新中心许琛琦教授、北京大学孔燕教授、百济神州沈志荣教授等发表在《Cell》上的文章,作者发现FGL1与LAG3结合,激活E3连接酶c-Cbl和Cbl-b介导的LAG3泛素化过程,从而激活LAG3的抑制信号传导,增强LAG3介导的抗肿瘤免疫抑制。

01、研究内容
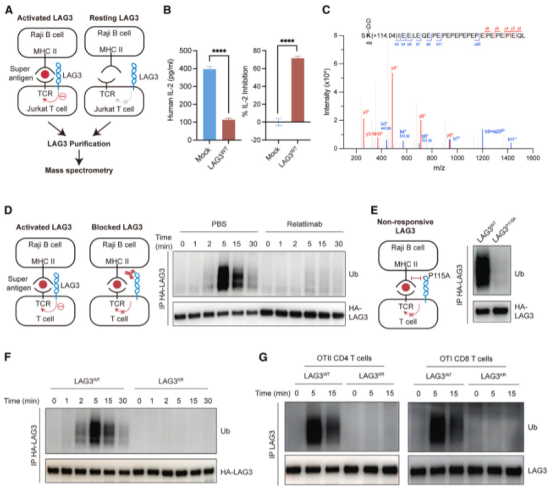
在T细胞激活的关键阶段,当MHC II类分子与相应配体成功结合后,会立即引发LAG3蛋白发生快速泛素化修饰,从而调控免疫应答进程
为探究LAG3在T细胞激活中的调控机制,研究团队构建了T细胞-APC共培养体系。将表达 LAG3的 Jurkat T细胞与表达MHC II类分子的Raji B细胞进行共培养,运用免疫沉淀 - 质谱技术分析发现,激活状态下的T细胞中LAG3发生泛素化修饰,且特异性作用于K498位点。
随后,通过免疫印迹实验、突变体构建等多种验证手段证实,LAG3的泛素化过程呈现出配体依赖特性,同时与治疗性抗体的阻断效果密切相关。
研究最终揭示:在T细胞激活进程中,MHC II 类分子结合可触发LAG3胞质尾中部保守的赖氨酸残基快速泛素化,这一分子事件对LAG3发挥免疫抑制功能起到决定性作用,为理解肿瘤免疫逃逸机制及靶向LAG3的免疫治疗策略提供了重要理论依据。
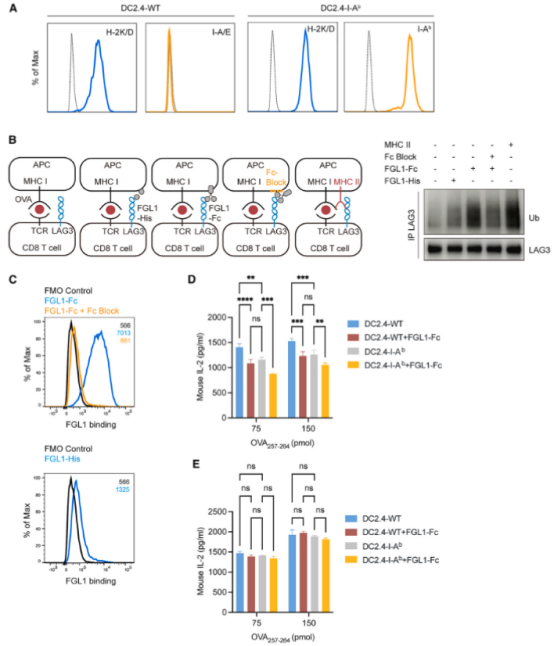
在抗原呈递细胞上,膜结合型FGL1能够诱导LAG3泛素化
为探究 FGL1-Fc蛋白对 LAG3泛素化的影响及其免疫调控作用,研究人员将表达内源性LAG3 的 OTI CD8 T细胞,与不同类型的抗原呈递细胞(APCs)进行共培养实验。
实验中设置两组条件,一组添加 FGL1-Fc蛋白,另一组作为对照,观察共孵育5分钟后LAG3的泛素化水平变化。结果显示,相较于MHC II类分子介导的作用,FGL1-Fc蛋白诱导的LAG3泛素化程度较弱,且该过程高度依赖FGL1-Fc与APC细胞膜的有效结合。
后续功能验证实验表明,FGL1-Fc能够通过依赖LAG3的作用机制,显著抑制IL-2的产生,揭示了FGL1-Fc在调节T细胞免疫应答中的关键作用,为解析免疫调控机制提供了新视角。
LAG3泛素化并没有导致降解,反而正向调节了LAG3的功能
为探明LAG3泛素化的生物学功能,研究团队通过双重策略展开探究。一方面,对比野生型与 LAG3KR基因编辑小鼠的 T 细胞,分析LAG3蛋白表达差异,并利用环己酰亚胺阻断蛋白质合成,监测LAG3的代谢周转过程,证实其泛素化修饰并不引发蛋白降解;另一方面,借助质谱技术与特定泛素突变体工具,锁定LAG3主要发生非K48连接的泛素化,尤其是K63型多泛素化修饰。
在 Jurkat T细胞与Raji细胞的共培养体系中,靶向LAG3的治疗性抗体relatlimab展现出显著抑制效果,完全阻断LAG3的泛素化进程。这一系列实验共同揭示:LAG3的泛素化并非促进蛋白降解,而是作为正向调控机制,通过非降解性修饰增强其免疫抑制功能,为理解 LAG3介导的免疫调控网络提供了全新理论依据。
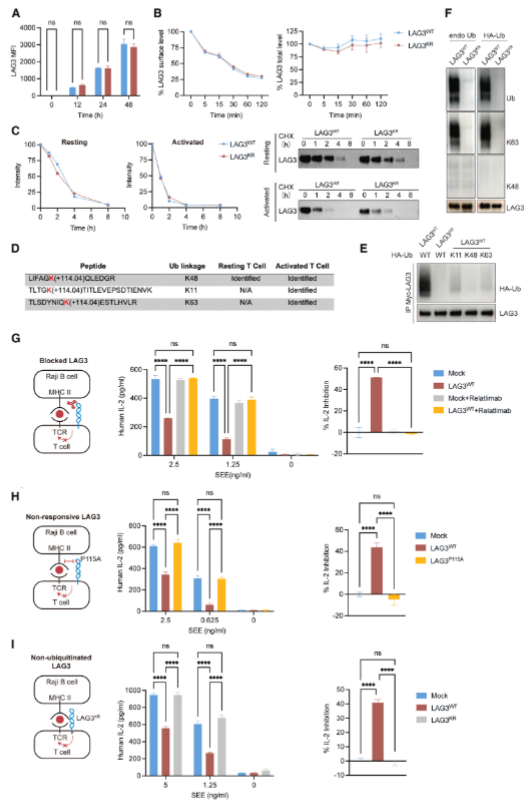
Cbl家族连接酶介导LAG3的泛素化
为破解 LAG3泛素化过程中关键E3连接酶的作用机制,研究团队采用 TurboID邻近标记技术,将TurboID蛋白融合至LAG3的C末端,以此为 “探针” 深入挖掘参与LAG3泛素化修饰的关键分子。在激活的T细胞样本中,研究人员成功锁定 c-Cbl与Cbl-b这两种Cbl 家族E3连接酶,推测其可能是调控 LAG3泛素化的核心参与者。
为验证上述假设,研究人员对Jurkat T细胞中的 c-Cbl与Cbl-b基因展开单敲除与双敲除实验。结果显示,单独敲除任一基因均无法完全阻断LAG3 的泛素化修饰,唯有同时敲除c-Cbl与 Cbl-b基因,才能彻底终止这一过程。进一步实验发现,在双敲除细胞中重新引入c-Cbl 或Cbl-b,可使LAG3 泛素化水平恢复,且这一现象在人类原代T细胞中得到重复验证。体外泛素化实验更直接证实,c-Cbl 能够直接介导LAG3的泛素化修饰。
综合系列实验结果表明,c-Cbl与Cbl-b在介导LAG3泛素化过程中呈现功能冗余特性,二者协同作用维持LAG3的正常泛素化修饰水平。这一修饰过程对 LAG3发挥免疫抑制功能起到不可或缺的作用,为解析肿瘤免疫逃逸机制及靶向 LAG3的免疫治疗策略提供了重要分子靶点依据。
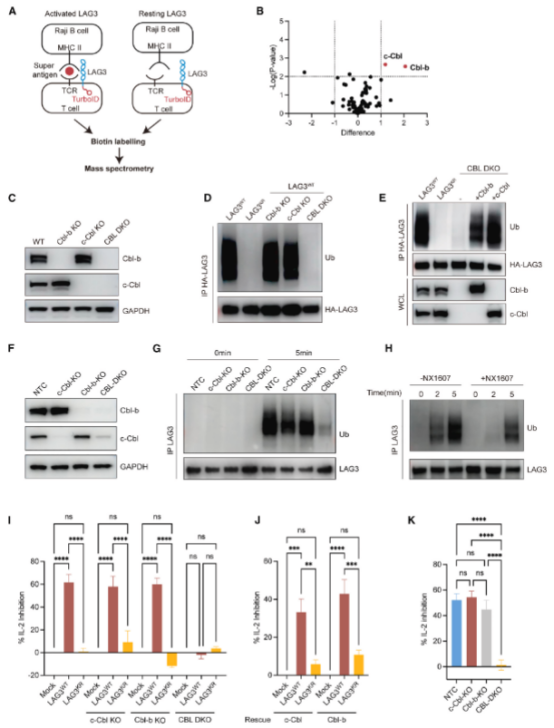
泛素化阻碍了LAG3胞质尾部与膜的相互作用
在对 LAG3分子结构的深度解析中,研究人员通过序列比对发现,LAG3跨膜区域附近存在一段保守的富含碱性氨基酸的序列(BRS)基序,该基序与FSALE信号基序紧密相邻。借助荧光共振能量转移(FRET)技术,研究团队证实LAG3的N末端细胞质区域能够在细胞内与细胞膜发生特异性结合;进一步利用核磁共振(NMR)光谱分析,明确了FSALE基序可精准插入细胞膜疏水核心,实现稳定锚定。
为探究泛素化修饰对LAG3膜结合特性的影响,研究人员构建了模拟泛素化状态的LAG3融合蛋白,并通过荧光偏振(FP)实验发现,泛素化修饰会显著削弱LAG3与细胞膜的结合能力。在此基础上,团队设计并合成了LAG3突变体(LAG310AA),实验结果显示该突变体不仅能显著增强 LAG3的免疫抑制功能,还能有效弥补LAG3KR突变体的功能缺陷。
综合系列研究表明,LAG3的泛素化修饰通过干扰其与细胞膜的结合状态,促使抑制信号基序暴露,进而增强其对免疫应答的负调控作用。这一发现揭示了LAG3功能调控的全新分子机制,为靶向LAG3的肿瘤免疫治疗策略开发提供了重要理论依据。
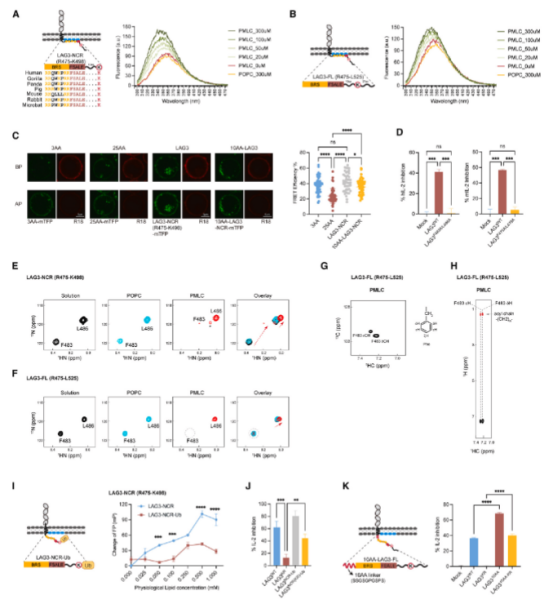
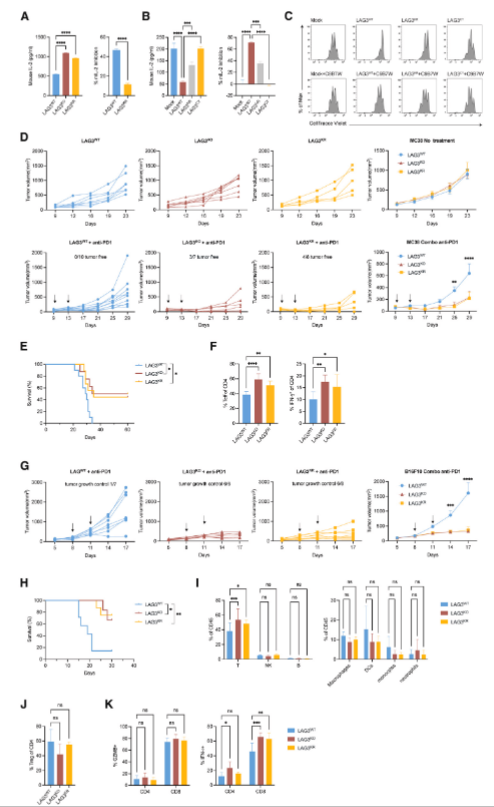
LAG3的泛素化对LAG3介导的抗肿瘤免疫抑制至关重要
为探究 LAG3泛素化对T细胞功能及抗肿瘤免疫的影响,研究团队利用LAG3KR(泛素化缺陷)和 LAG3KO(基因敲除)两种小鼠模型展开深入研究。实验结果显示,LAG3泛素化缺陷会显著削弱T细胞的抑制功能,表现为细胞因子分泌水平显著升高,同时T细胞增殖抑制能力明显下降。
在后续的体内抗肿瘤实验中,研究人员通过构建MC38和B16肿瘤模型进一步验证。结果表明,无论是LAG3泛素化缺陷还是基因敲除,均能有效激活机体抗肿瘤免疫反应。荷瘤小鼠的肿瘤生长速度明显减缓,生存周期显著延长。这一系列研究揭示了LAG3泛素化在调节T细胞功能和抗肿瘤免疫中的关键作用,为肿瘤免疫治疗提供了新的潜在靶点和理论依据。